通告发布情况
近期,国家药品监管部门公布,有13个药品批次不符合规定标准。这一消息迅速在医药界及公众中引发了广泛关注。药品安全与公众健康息息相关,此次多批次药品不合格的公布,对行业起到了警示作用。药监局迅速且准确地发布了相关信息,其目的是确保公众用药安全,并维护药品市场的秩序。
不合格药品可能降低治疗效果,并潜在威胁患者健康。本公告针对多类药品,涉及众多生产商。披露相关信息有助于监管机构增强监管效能,同时促进企业提高药品品质。
石家庄格瑞药业情况
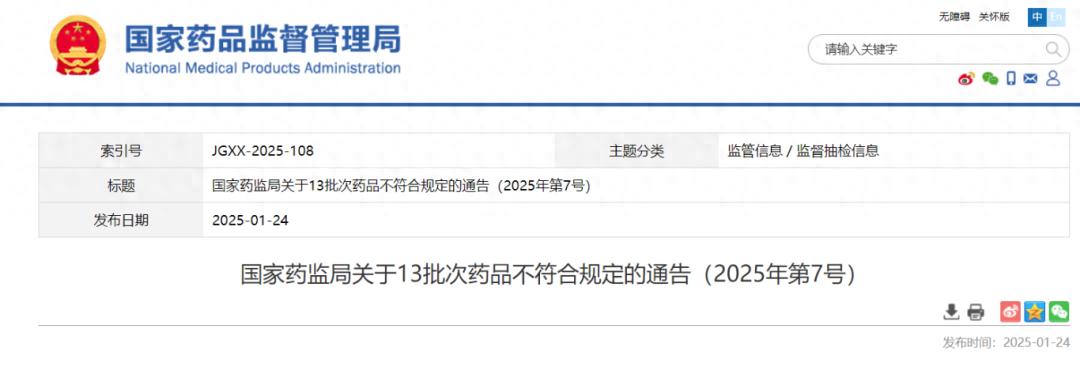
石家庄格瑞药业有限公司生产的阿昔洛韦滴眼液,涉及三个批次,已列入最新公布的药品不合格名录。产品不合格的主要问题在于可见异物。阿昔洛韦滴眼液是眼科治疗常用药物,主要针对多种眼部感染。
检测结果显示,产品中杂质含量超过标准,这表明生产环节可能存在卫生问题或过滤技术上的不足。该批药品已进入市场流通,使用后可能增加眼部感染的风险。相关部门已责令企业即刻停止销售及使用,并已启动药品召回流程。目前,相关部门正在调查该问题的根本原因。
通化仁民药业情况
通化仁民药业股份有限公司生产的尼可地尔片某批次检测出质量问题,主要问题出现在含量检测环节。该药品主要用于治疗心绞痛等疾病。若药物含量不准确,将直接影响治疗效果。

若药物成分不符合既定规范,患者用药后可能无法实现预期疗效,甚至可能恶化病情;而成分含量超标亦可能诱致不良后果。监管机构已迅速采取行动,责令企业即刻进行整改,这对于确保患者用药的准确性和安全性极为关键。同时,相关部门亦将持续监控企业整改措施的实际执行效果。
湖南一格制药情况

湖南一格制药有限公司生产的两种胸腺肽注射剂在活力检测中未能达到标准。这两种药品归类于免疫调节类,它们在临床上广泛用于治疗原发性与继发性免疫缺陷相关疾病。
检测数据揭示,该药品活力未达到标准,暗示其免疫调节功效可能显著降低。若此类药品应用于患者治疗,恐难有效提升患者免疫力,甚至可能错过治疗的最佳时机。监管机构已要求企业实施风险管理,彻底调查问题源头并执行必要的整改措施。
丹东医创药业情况
丹东医创药业有限责任公司生产的炎琥宁注射剂在某次物质检测中未达到规定标准。该产品主要用于治疗病毒性肺炎及上呼吸道感染等疾病。
药品若含有违禁成分,可能指示其杂质含量已超过安全标准。此类杂质若被人体吸收,可能造成不良生理反应。这不仅意味着治疗目的无法实现,还可能对患者的健康构成威胁。鉴于此,药品监管部门已责令相关企业迅速行动,对涉事药品实施召回及处理措施。
中药材企业情况
本次公告列出的中药企业有安国久旺药业、江西齐仁堂、四川沱江源药业以及四川天植中药股份。在这些企业生产的防风产品中,有四批次样品因水分含量不符合标准,被判定为不合格。安徽康和中药科技生产的红花产品中,有一批样品被发现含有酸性红73、柠檬黄、胭脂红、日落黄等非法添加剂。此外,安国荣华本草中药材有限公司生产的合欢花产品,杂质含量也未达到规定要求。
中药材的品质直接关系到中药配方的治疗效果和成药的治疗效果。若药材含水量超标、含有非法成分或杂质,将导致药效降低并可能影响用药安全。相关部门已责令相关企业进行整改,并已展开案件调查,旨在整顿中药材市场秩序,确保中药品质的安全。

近期药品质量问题屡次出现,关于加大监管力度的观点众说纷纭。您对此有何看法?敬请于评论区留言。此外,不妨对本文给予点赞,并予以推广。